相信对于肿瘤基础研究的广大入门者来说,如何快速并准确地寻找感兴趣且有研究前景的课题方向一直是最为关注和棘手的问题。现在我们这里向大家介绍提供一套简单有效的探索方法。
众所周知,肿瘤基础研究一般的热点方向主要包括肿瘤增殖调控、肿瘤细胞凋亡机制、肿瘤细胞自噬机制和肿瘤细胞代谢调控等的研究。那么有没有哪个靶点在上述研究方向都有参与,这样研究这一个靶点便能迅速掌握多个方向的机制和研究热点?现在我告诉你,这样的分子的确存在,并且相信大家对它都非常熟悉,它就是p53。那么肯定有人会问p53都已经研究得很透彻了,对于初学者来说都很普通,那它还有什么意义去继续深挖呢?
我想告诉你,正是由于p53的基本功能研究的较透彻并且在多个方向都有涉及,我们才能顺着p53这个靶点去寻找研究新的靶点所在通路及相关通路之间的联系,相当于我们拿着p53这把“万能钥匙”,不管是那扇肿瘤机制的门,我们都能一一开启它,最终获得我们预期的研究成果。
相信很多人仍在怀疑我的上述说法,那么接下来我就向大家展示一下p53的神奇之处,限于篇幅,这里我只做简单的通路讲解和通路关系分析,旨在向大家说明一个大概的研究思路和方向,至于具体的调控关系,以后有机会再向大家详细介绍,大家感兴趣也可以直接与我讨论交流一下。
下面我先跟大家简单说一下p53,熟悉的人可以直接跳过,进入通路关系分析。
p53 基因属于抑癌基因,位于染色体17p13.1,基因全长16~20kb,含11个外显子,并且2~11外显子编码分子量为53kD的p53蛋白分子。P53作为转录因子能够调节各种各样基因的表达,其中包括细胞凋亡、生长抑制、抑制细胞周期进程、分化和加速DNA修复、基因毒性和细胞应激后的衰老等。
正常野生型p53 在细胞核内发挥转录调控作用,但也能在细胞质中发挥相应功能。P53在细胞内的不同分布能发挥不同的功能。P53蛋白功能的发挥一般依赖于蛋白分子的乙酰化和磷酸化修饰。通常细胞内的p53合成后在细胞核内被mdm2结合并运出细胞核进行泛素化降解,但细胞受到外界刺激的情况下,比如DNA损伤,p53被磷酸化导致p53分子在细胞核内稳定下来避免被降解并进一步被激活发挥转录因子功能。同时,p53的乙酰化修饰也能促进p53的稳定并加强其转录活性。这是p53一些最基本的分子信息,掌握这些有利于加强对p53功能的理解和调控网络的分析。另外,具体关于p53分子结构和调节网络这里就不赘述了。下面直接进入正题。
P53与细胞增殖
正常细胞在多种机制监控下能够进行正常的受控制的增殖活动。当细胞受到外界刺激时,细胞DNA出现损伤,这时p53便被激活发挥细胞周期阻滞和细胞DNA修复功能,减少细胞发生变异并发生癌变的可能性。P53被激活后能够转录激活下游基因P21, P21可与一系列Cyclin-cdk (细胞周期蛋白依赖性激酶)复合物结合,抑制相应的蛋白激酶活性,导致高磷酸化Rb 蛋白(视网膜母细胞瘤蛋白)堆积,进一步阻止E2F转录因子(参与细胞周期调控的细胞因子)活化,引起G1期阻滞;另外P53的其它3个下游基因Cyclin B1,GADD45 和14-3-3σ则参与了G2/M期阻滞。
P53与细胞凋亡
当细胞损伤超出细胞修复能力时,p53便激活相应的凋亡通路来诱导受损细胞的死亡,从而减少癌症的发生率。细胞凋亡主要包括两个凋亡通路:外部途径和内部途径。
外部途经主要经过死亡受体蛋白的激活,与其相应受体形成通过DISC,导致一系列半胱天冬酶激活,包括Caspase 8和 Caspase3,进而诱导细胞凋亡。最常见的死亡受体包括Fas、DR5和PERP。内部细胞凋亡途径受Bcl2家族蛋白的控制,Blc2家族蛋白能控制Cyto C从线粒体中释放。Blc2家族由抗凋亡和促进凋亡两部分组成。Blc2家族可以分为两类:一类是促生存蛋白,它们在结构上和Blc2很相似,例如Bcl-XL;一类是促凋亡蛋白,如BAX和BAK,它们的结构和Blc2和Bcl-XL很相似,起到抵抗促生存蛋白作用。P53能够通过转录激活Fas等死亡受体蛋白进一步引起凋亡;另外,p53可以在细胞核内转录激活BAX, Noxa, PUMA和BID等促凋亡蛋白,同时P53也可能转录抑制Blc2。除此以外,p53在细胞质中还能与bcl-2结合从而释放bax发挥出凋亡的作用。因此,p53在细胞凋亡中发挥重要的调控作用,并通过诱导细胞凋亡发挥肿瘤抑制因子作用。
P53与细胞自噬
细胞自噬,是一种存在于真核细胞中的,在进化上非常保守的依靠溶酶体来降解细胞质中组件的降解途径。细胞的正常自噬反应有利于细胞内环境的稳固以及细胞各项生命活动的进行。但如果自噬出现失调时,便会引起许多相关疾病,如癌症,神经病变,心肌病等。P53对自噬的调控作用与其在细胞内的位置有关。当p53处于细胞核内时,p53能够通过转录依赖性途径上调PTEN、AMPK、sestrin等mTOR上游调控因子促进自噬,同时可以激活DRAM和DRAK 等以不依赖于mTOR途径激活自噬;但当p53转移至细胞质,可以通过抑制mTOR和beclin1等活性来抑制自噬。因此,p53对自噬的调控要根据细胞具体情况来决定。
P53与细胞能量代谢
细胞的各项生命活动都离不开能量的支持,癌细胞的快速增殖尤其需要大量的能量供应。细胞内最重要的能量代谢是糖代谢,主要包括糖酵解和氧化磷酸化,P53在糖酵解和有氧氧化的调控中发挥重要作用。P53能够转录激活SCO2等线粒体电子传递链蛋白促进细胞的有氧氧化,另外p53通过转录激活TIGAR抑制糖酵解关键酶和转录抑制PGAM来抑制糖酵解的进行。P53突变引起的代谢方式改变是肿瘤发生的重要原因。
P53在多个肿瘤研究方向的功能就简单做上述介绍,相信大家对p53在某一方面或几个方面的功能一定有所了解,但我相信入门者中没有几个人会把p53在各个调控网络的关系整合起来一起研究,这便是我说的快速有效的研究方法:
以p53为中心建立整个癌症相关热门调控网络:
如果你发现某个新的靶点,那么只要你把它放在相应要研究的通路中,与p53建立一定联系,便可以将其上下游关系理清并进一步阐明机制;
如果你想研究通路之间的关系,从p53出发也马上能建立起一系列的通路互作网络;
再或者你想研究某药物对肿瘤的作用机制,你也可以按照预想的作用模式从p53出发研究药物的作用通路。
总之,只要你围绕p53这个中心点,按图索骥,对于初学者来说,很多比较热点的肿瘤研究方向和靶点便能迅速浮出水面。什么?上面的具体机制你不想花太多时间去了解,那怎么办?没关系,我这里直接给你上图,你就直接跳过上述废话连篇的机制说明,直接在图中按照上述方法拿着p53这把万能钥匙进行课题寻找,相信这么简单有效的方法你肯定能很好掌握并熟练应用于你的课题寻找,一个好的课题出来了,还愁没有高分文章吗?
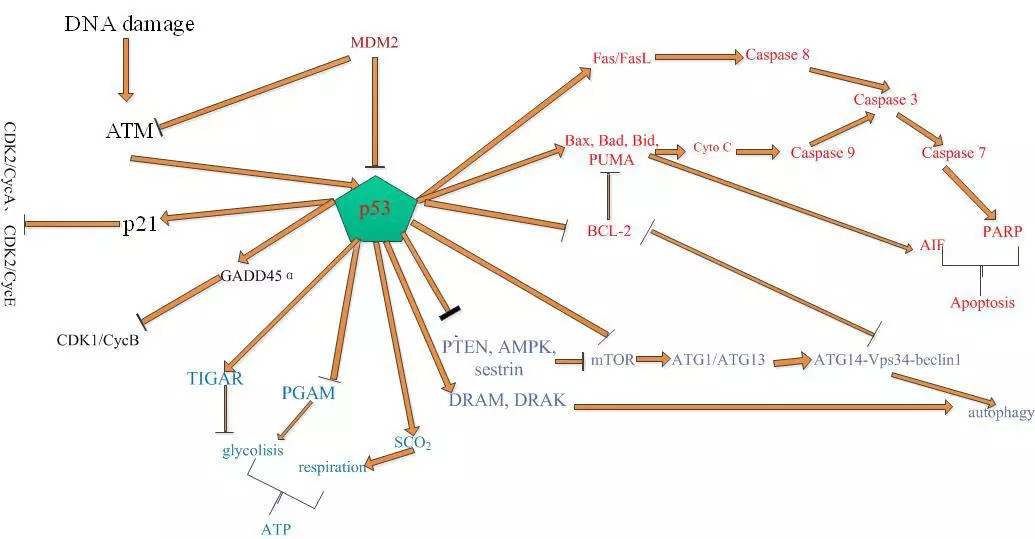
p53在各通路中的调控网络
作者:解螺旋.包子解螺旋出品
2015-07-22
