Bac-to-Bac昆虫杆状病毒表达系统可以快速、高效的制备重组杆状病毒,该系统依赖一个位点特异性的转座将一个完整的表达元件重组到杆状病毒的穿梭质粒上(bacmid)。该系统主要包含以下几个部分:
pFastBac载体:包含杆状病毒特异的启动子,在其下游插入目的基因后形成一个完整的表达元件。这个表达元件届时会以转座子的形式插入到穿梭质粒上。
DH10Bac菌株:包含一个杆状病毒穿梭质粒(bacmid),一个辅助质粒。辅助质粒表达转座酶,帮助完成转座过程。DH10Bac的基因型为:F– mcrA Δ(mrr-hsdRMS-mcrBC) φ80lacZΔM15 ΔlacX74 recA1 endA1 araD139 Δ(ara, leu)7697 galU galK λ– rpsL nupG/bMON14272/pMON7124。
因为涉及到转座重组,所以必须得提一下这个系统用到的Tn7转座子。Tn7转座子:大肠杆菌中的一种位点特异性的转座子。结果如下:
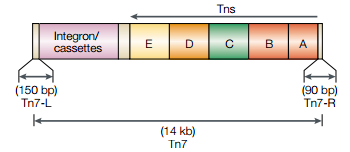
必须的元件:
Tn7-L: 约150bp
Tn7-R: 约90bp
任何片段只要带上了Tn7-L和Tn7-R这两个元件,就可以在Tn7转座蛋白的辅助下完成转座过程。Tn7-L与Tn7-R序列不同,它们决定了转座子插入的方向。Tn7的每个末端都含有约22bp的转座酶结合位点。
Tn7转座蛋白
Tn7编码5个转做蛋白,分别是TnsA, TnsB, TnsC, TnsD, TnsE。其中TnsA和TnsB形成转座酶,特异性识别转座子的末端,并将Tn7从供体上剪切下来,形成双链DNA断裂,然后将这些末端插入到目标位点中。TnsC非特异的结合DNA,在ATP存在下,会协助TnsA和TnsB完成剪切和插入过程。TnsD和TnsE的功能主要是来寻找插入的靶位点,单纯的TnsABC是不能完成重组过程的。
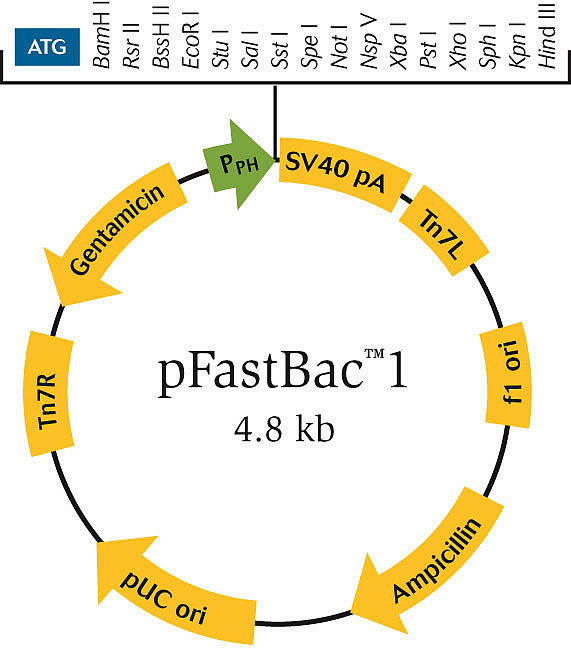
本文主要以pFastBac 1载体进行讲述,其他载体原理都差不多。
pFastBac 1载体的特点是:
含有强AcMNPV(苜蓿银纹夜蛾多(核壳体)核型多角体病毒)多角体蛋白启动子(pPH),促进蛋白高效表达。
多个MCS,便于克隆
pFastBac 1含有PH启动子,促进蛋白在昆虫细胞中的高水平转录。在启动子的下游插入目的基因,再下游是SV40的多聚腺苷酸加尾信号。整个表达框与庆大霉素的编码基因、Tn7-L和Tn7-R一起形成mini Tn7。
DH10Bac菌株,也就是pFastBac载体的宿主菌,包含有一个杆状病毒穿梭质粒(bacmid)。Bacmid上含有个mini-attTn7位点。另外,DH10Bac还含有一个辅助质粒(pMON7124 (13.2 kb), 四环素抗性,编码转座蛋白)。一旦pFastBac质粒转化到DH10Bac菌中,mini Tn7就发生转座,从pFastBac切下,插入到mini-attTn7位点中,形成重组bacmid。转座过程需要的蛋白质由辅助质粒表达提供。
一旦完成了转座,我们需要从DH10Bac菌种分离出大分子量的重组bacmid,转化到昆虫细胞中,形成重组杆状病毒,也就是P1代病毒(滴度低,只能做初步小试实验)。然后将P1代病毒,再次感染昆虫细胞,进行病毒扩增,形成P2代病毒(滴度高)。P2代病毒就可以用于大规模的重组蛋白表达了。
Bacmid的名称是bMON14272 (136 kb),是个杆状病毒-大肠杆菌穿梭质粒,其特点是:
低拷贝的mini-F复制子
卡那霉素抗性筛选标记
含有LacZα的编码基因,同时在LacZα的N端插入有mini-attTn7位点,该位点不会影响LacZα编码基因的通读和功能。因此Bacmid如果没有发生重组的话,在X-gal和IPTG的存在下,同时宿主菌基因型为lacZΔM15时,会形成蓝色的菌落。相反,如果在mini-attTn7有基因插入的话,则会形成白色的菌落。
使用建议:
1. 推荐使用的昆虫细胞为Sf9和Sf21
2. 用无血清培养基
3. 由于昆虫细胞对环境条件敏感,推荐的培养温度为27-28℃;pH 6.1-6.4; 渗透压: 345-380 mOsm/kg; 10%-50%的溶氧饱和度; 剪切力:悬浮培养的时候会产生机械剪切力,有时候需要加保护剂,如Pluronic-68.
4. 转染时,需要取对数生长期的细胞,活力要求大于95%
一般来说,Bac-to-Bac昆虫杆状病毒表达可以分为以下几个步骤:
1. 将目的基因克隆到pFastBac载体上
2. 将上述质粒转化DH10Bac菌株中,制备重组Bacmid
3. 将重组Bacmid转化昆虫细胞,制备重组杆状病毒
4. 扩增杆状病毒,感染昆虫细胞,表达重组蛋白。
Souce: 纽普生物 2016-09-09