过去的十多年间,科学家们发明了很多种构建克隆的方法。这些方法相较于最经典的限制性内切酶克隆方法而言,各有优缺点。传统的限制性内切酶克隆技术,会在两个片段的结合位置上形成一道“疤”或“缝”,这种瑕疵可能会对DNA片段的行为产生微妙的影响。这一点特别令合成生物学家头疼,因为他们常常要将启动子和终止子这样的DNA片段转变为可预测的独立元件。今天我们就来说说一种无缝克隆方法。
Gibson组装
Gibson组装最早由Daniel Gibson博士和他的同事J. Craig Venter在2009年提出。Gibson组装非常适合用于拼接多个线性DNA片段,当然也适合将目的DNA插入载体中。如下图所示,首先,需要在DNA片段的末端加上同源片段(通过PCR法加上);然后,将这些DNA片段和一种master mix(含有三种酶)混合孵育一个小时就可以了。这种master mix含有三种不同类型的酶:
一种外切酶,从5’端开始对DNA进行消化,产生长的黏性末端,这样便于与另外的同源末端进行配对结合。
一种聚合酶,用于修补gap
一种DNA连接酶,实现无痕拼接,形成完整的DNA分子。
这个系统最厉害的是,这三种酶都可以在同一个温度下很好的发挥功能,所以整个反应在50摄氏度条件下一个小时就可以完成。一小时后,样品可以直接用于转化。master mix可以从NEB或者SGI-DNA公司购买,或者直接自己配置,(参见Miller Lab Protocol)。Gibson组装可以在一个反应中最多拼接6个DNA片段,无需特定限制性酶切位点。
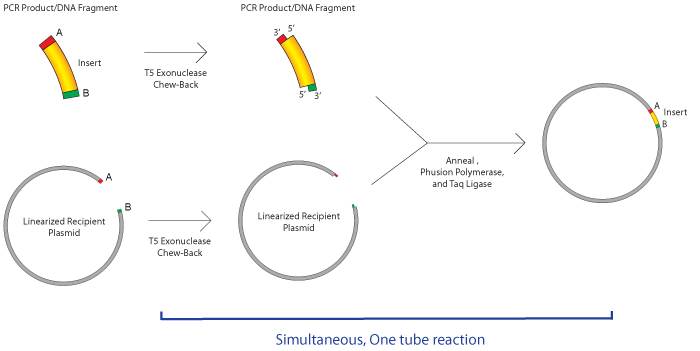
实验流程
这项技术需要通过PCR的方法在DNA片段的两端加上同源片段,NEB推荐同源片段的长度为15-40bp,同时要求这部分对应的退火温度高于48摄氏度。现在假设一种情境,我们要将一个目的基因构建到表达载体上,同时在这个目的蛋白的N端融合上一个大的融合标签,帮助蛋白表达/检测/纯化。如果按照常规的限制性内切酶克隆方法,一般需要做两步,先插入一个基因,测序没问题后再插入另外一个基因。而现在如果用Gibson组装克隆方法,就可以直接一步完成该克隆构建。首先我们要需要设计引物扩增出这两个DNA片段,同时这个两个DNA片段有各有一部分是同源的,这样便于它们之间进行连接;同时这两个DNA片段与载体上各有一部分是同源的,这样便于它们与载体进行连接。然后,两个DNA片段进行克隆之后,需要进行DNA纯化。最后将线性化的载体片段,这两个DNA片段和Gibson assembly master mix孵育一个小时后直接转化感受态细胞。该方法成功率非常高,一般不需要筛选很多克隆就可以拿到正确的克隆。

Gibson组装克隆法也是有缺点的,缺点之一是适用与长度超过200bp的片段的组装;缺点之二是如果黏性末端形成稳定的二级结构,如发夹结构或者茎环结构,那么成功率会大受影响。
Gibson组装克隆法与CRIPSR
Gibson组装克隆法与CRIPSR结合起来会发生什么反应呢?让我们来看看两篇文献报道,第一篇是Lockey实验室的(Wang, et al. 2015),文章中他不是用PCR或者限制性内切酶来制备线性的质粒载体,而是通过Cas9酶的在特定位点的剪切来完成。很明显,这不是其他方法能够简单做到的。第二篇(Jiang et al. 2015)讲述的是,利用CRISPR技术从细菌的基因组上切了非常大的一个片段(100kb),然后通过Gibson组装克隆到载体上。从这两篇文献可以看出Gibson组装克隆法的独特优势。
Souce: 纽普生物 2016-07-21