近年来,人们已经逐渐意识到,父亲可能通过多种途径对自己后代的健康产生影响,比如生活习惯、年龄等等。今天,小鱼盘点了近期相关的研究来进一步解释父亲对后代胚胎生存率、患癌风险及其精神状态的影响。
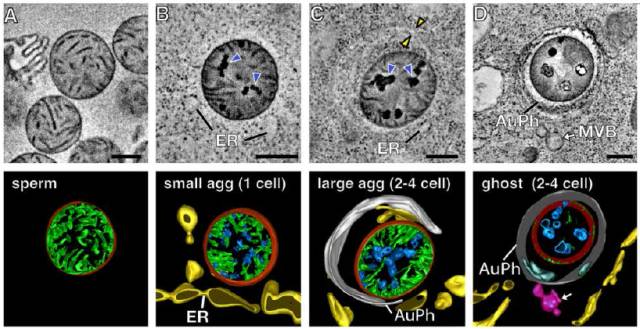
几乎在所有动物的繁殖期间,只有母本线粒体能传递给后代,而父本的线粒体则在受精卵形成后被选择性的摧毁。为了弄清楚这个过程背后的具体机制,本文的研究人员通过电子显微镜和X线断层摄影术研究了多细胞蠕虫——秀丽隐杆线虫(Caenorhabditis elegans)雄性精子的线粒体。
研究发现父本线粒体中Cps-6基因表达了一种核酸内切酶G,能在被胞质内的自噬体降解前,就先降解父本线粒体内膜,并破坏线粒体内膜完整性,进而导致线粒体DNA自我降解。当研究人员抑制父系线粒体CPS-6的表达时,父本线粒体在胚胎发育后期的降解就会被抑制,且胚胎的生存几率降低,这说明父系线粒体的传递对进化不利。
研究人员同时指出人类线粒体也有一种类似的核酸内切酶G,暗示着同样的自我摧毁过程可能也在人体内发挥作用。
分析其原因,研究人员认为精子在与其他精子竞争线粒体时,需要线粒体产生大量的能量,在这种情况下,线粒体产生了很多氧自由基,进而会诱导线粒体DNA发生突变,所以机体进化出一套机制将父本线粒体从受精卵中清除掉。
参考文献:Mitochondrial endonuclease G mediates breakdown of paternal mitochondria upon fertilization.
父亲原罪之表观遗传
1 父亲肥胖,女儿易患乳腺癌?

本文首次通过小鼠动物实验发现受精期间父亲肥胖将增加后代癌症风险,为父亲的健康饮食敲了一个警钟。该研究中,肥胖雄性小鼠与正常体重雌性小鼠所生育的雌性幼崽,不仅从出生到整个孩童时期的体重超标,而且它们的乳腺组织发育滞后,乳腺癌的发生率也有所增加。
通过进一步研究发现,肥胖可改变父亲精子和女儿乳腺组织中的miRNA表达谱(如miRNAs 296-5p,874和1896),表明miRNAs可能携带来自肥胖父亲的表观遗传信息,并传递给他们的女儿。这些miRNA可调节胰岛素受体信号改变机体的体重,同时也参与调节一些肿瘤发展相关分子信号通路(如缺氧信号通路)。
另外,去年哥本哈根大学的研究团队也发现,肥胖男性和精瘦男性的精子存在显著的表观基因组差异,也证实了男性可通过精子将生活环境的信息传递给后代,影响孩子的肥胖几率。因而一般建议:为了你们的后代着想,男性和女性一样需要保持一个健康的体重和生活方式。
参考文献:
Paternal overweight is associated with increased breast cancer risk in daughters in a mouse model;
Obesity and bariatric surgery drive epigenetic variation of spermatozoa in humans.
2 父亲饮食习惯差,子女代谢易紊乱
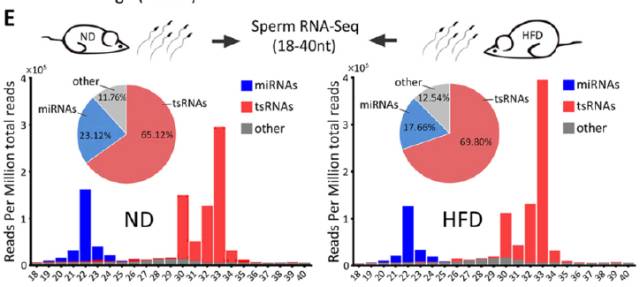
中国的科研研究者将雄性老鼠分为高脂饮食(HFD)和正常饮食(ND)两组,并用这两组小鼠的精子使卵子受精,发现高脂饮食雄性小鼠的后代会出现糖耐量减低和胰岛素抵抗,而且这种糖耐量减低与tsRNA(30-34nt)有关。
同时研究者在对HFD和ND后代进行全基因组比对后,发现HFD小鼠的后代中,不少代谢基因的表达水平显著减少。这些发现说明,父亲的饮食能通过精子tsRNA,导致获得性代谢紊乱的跨代遗传。
参考文献:Sperm tsRNAs contribute to intergenerational inheritance of an acquired metabolic disorder.
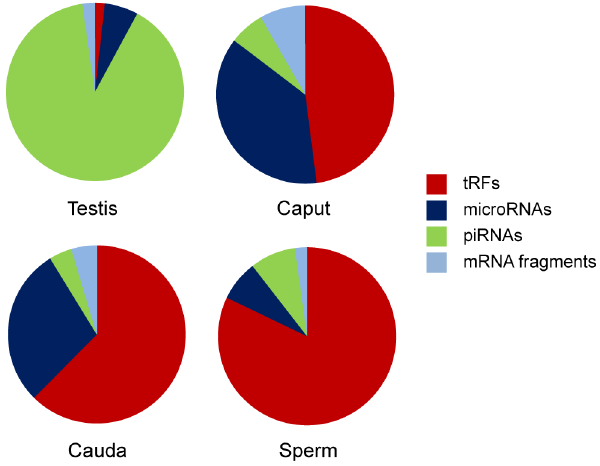
另外,麻省理工医学院的研究者为了解释饮食对精子tRNA的影响,对低蛋白(LP)饮食的小鼠进行了研究,并发现睾丸中未成熟精子的小RNA与LP饮食没有对应关系,但是附睾中成熟精子的tRNA则受到了显著影响,相比正常对照组,LP小鼠的tRNA-Gly-GCC水平明显增高,并可抑制基因表达,严重影响小鼠胚胎干细胞的可塑性。
这两项研究均展示了父亲饮食对精子tRNA的影响,并可改变后代的基因调控,引起相应的代谢紊乱。
参考文献:Biogenesis and function of tRNA fragments during sperm maturationand fertilization in mammals.
高龄父亲精子中携带有精神病症隐患
昆士兰大学的研究人员利用基因芯片筛选技术比较了3月龄雄性老鼠与14-16月高龄老鼠后代的遗传差异,发现高龄老鼠后代DNA中新增一些拷贝变异数(CNVs)和单个碱基的改变(增加或减少),并产生一些行为异常的举动。
通过进一步研究,他们发现高龄父亲(40或40岁以上)的子女精神发育障碍风险增加2倍,并利用一种数学模型揭示了另一种可能性:精神疾病风险高的男性更有可能成为高龄父亲,并将风险因素遗传至后代。
另外,《JAMA Psychiatry》杂志曾报道了迄今为止关于父亲年龄和子女精神健康状况的最全面研究,发现与20至24岁年轻父亲的子女相比,45岁以上高龄父亲的子女患精神错乱(精神分裂症的标志性症状)的概率要高一倍,被诊断出自闭症的概率高出两倍以上,被诊断出注意力缺失症的概率要高出约12倍。
参考文献:
Risk of psychiatric illness from advancedpaternal age is not predominantly from de novo mutations;
Paternal Age at Childbearing and OffspringPsychiatric and Academic Morbidity.
Souce: 解螺旋 2016-07-08