本文仅针对从来没有做过或者即将做过qPCR引物的小伙伴。
全文分两部分,第一部分就是简单粗暴的设计qPCR引物,到这一步,单纯需要qPCR引物的小伙伴可以去联系公司订购引物了,有耐心的小伙伴可以看下第二部分,松哥有大招留着,绝对是泡萝莉师妹、约冷艳师姐、钓鲜肉师弟的神器。

松哥一向高效率,按照老外的传统,咱开门见山,需要的准备工作如下:
-
一个目的基因
-
一台能上网的电脑
OK,开始,首先我先说明,本方法松哥采用的是primer3 在线设计软件,打开primer 3网站,请自行度娘,名称如下:

第一步:选择物种,我是做人类肿瘤的,所以自然选human。
第二步:你的目的基因序列黏贴进框框里
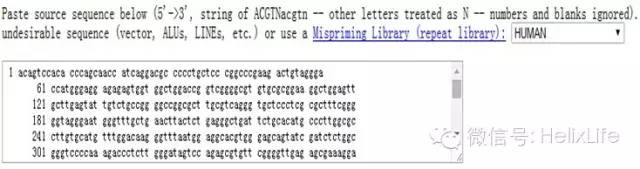
第三步:啥选项都不要动,直接点Pick Primer,引物就出来了!还贴心的告诉你扩增长度,引物的位置,一次给你4条,你就选2条去做,绝对没问题,并且引物是经过blast验证的,扩增长度合适,刚好做qPCR,是不是快如闪电?
好了,以上就是简单粗暴设计软件的内容,下面要讲的是如何做好qPCR。
“补充:还有一个建议是,你要qRT-PCR的基因如果很大众化,类似AKT、CCND1、KRAS、GAPDH等等,随便上pubmed上搜一个相关的研究报道,你就可以在文章的材料方法里面找到该基因qRT-PCR实验用的引物序列。艾玛,直接复制粘贴送去合成就可以了~
考虑大家习惯,还是写成一条条的便于记忆和浏览。
想做好qPCR,show出漂亮的结果,纠正不良的qPCR操作习惯,需要准备以下内容(以染料掺入法为例子)。
1. 设计目的基因引物。请参考以上内容,上海英俊默认是2OD,实际上2OD~5OD的价格是一样的,5OD做几千个样品是没问题的,我每次都是设计5OD,1OD/管,每次只溶解1管,其余4管冻存-80,理论上管用n年(每次松哥说到5OD,老板都会神秘的一笑)
2. 设计内参基因引物。这很重要,不同组织选择内参基因种类不同,常见内参有GAPDH、HPRT、ACTIN、UBC、UBB等等,不要人云亦云,自己去找文献看看目的组织内哪种内参最稳定,有钱的,需要数据可靠性高的,可以选择2种引物,更高大上的可以做3种及以上,然后利用qbase plus选择最稳定的引物(qbase plus请自行脑补充,松哥觉得完全没必要那么严格),这里绝对是装逼的地方,每次我说完这里,师姐师妹们的眼睛都是闪亮闪亮的,哦原来这样子。松哥是。。。善良的纯人,自然不会去想歪主意,请小伙伴们要把持住。
3. 准备一瓶灭菌超纯水用来稀释引物。虽然以前都说用TE缓冲液,但是qPCR还是用纯水的好,我当时比较款,用了ABI的超纯水,100ml打完折扣是100块钱,妈蛋,这TMD是水么,比五粮液还贵。英俊的引物说明很好(绝对不是做广告),加多少水到10umol都是告诉你的,请自觉寻找。
4. 在A工作区域内分装引物,加入灭菌水后,摇晃-10000rpm1分钟-分装40ul/管,我每次都是把上下游引物混在一起分装,这样比较方便,冻存后,每次用之前冰上溶解。
5. 在B工作区域内准备模版,cDNA 或者DNA,总之,1ugRNA,经逆转录合成cDNA 20ul体系的,我直接用纯水稀释到200ul。
6. 在C工作区域内加样,反应体系我反复摸索过了,96孔板内15ul反应体系既经济,反应又稳定,结果均一性比较好。
7.qPCR之前,先做一个普通PCR,跑电泳验证条带位置、引物扩征效率、同时产物测序以确定引物正确性,这一步很重要,注意别把PCR产物污染了工作区,一定要分区操作。所以跑普通电泳的地方要远离你qPCR加样区,否则,会死的很悲惨。旁边实验室的师弟因为产物污染实验室,项目被迫终止,去了别的学校做qPCR,所有样本、引物、PCR试剂全部丢弃。
8. qPCR加样结束后,离心,上机。PCR程序2步法虽然省时间,但是我还是喜欢三步法,即变性95,退火59,延伸72,40个循环,溶解曲线程序仪器一般自带。
9. 结束反应,导出结果入excel,利用2-△CTor 2-△△ct计算结果。
注意:qPCR产物一般不需要长,<200bp,也有人说<150bp,太长影响解链。老式的ABI 7300,7500需要加ROX校正每个样品设置3个复孔,出现一个不好的就把那个不好的给删掉,如果出现2个不好的呢?松哥的做法:删掉2个不好的。。。。粗暴吧。
来源:解螺旋
2016-06-17