众所周知,G-蛋白偶联受体(G-protein-coupled receptors,GPCRs)是生物学和医学上非常重要的膜蛋白,目前已经有15种GPCRs的结构得以确定。但是,GPCRs的结构非常不稳定;GPCRs的序列非常难以测定,这就造成了研究的困难和瓶颈。如何精确快速地测定GPCRs的结构及其氨基酸序列一直是该领域研究的热点和焦点。为了解决这一难题,科学家们开发出来一种全新的技术——热稳定技术(thermostabilisation)。就象太上老君的炼丹炉一样,通过测定和改变GPCRs的热稳定性来决定其结构和序列,调节其功能。Cell的一篇综述《A crystal clear solution for determining G-protein-coupled receptor structures》就详细解释和阐述了这一最新的技术。
什么是thermostabilisation技术?
众所周知,蛋白质的热稳定性是由它的氨基酸序列所决定的。但是,即使是氨基酸序列高度相似的蛋白质,如果来自不同的有机体,它们的热稳定性也可能完全不同。例如,来自火鸡的β1AR与来自人类的β1AR的氨基酸序列有76%是完全一致的,但是它们的热稳定性却完全不同。甚至,DNA的点突变也可以增加蛋白质的稳定性,比如KcsA、M13、DGK位置的点突变。因此,GPCRs的thermostabilisation技术的原理就是通过测量GPCRs的热稳定性来反推其氨基酸序列。
理论上,任何的热稳定性分析技术都可以使用,但是放射性配体结合试验因为其有着非常高的产量和灵敏度等显著优点,成为测量GPCRs的热稳定性的首选方法。目前,这一技术已经被成功地用于大肠杆菌(Escherichia coli)表面GPCRs的热稳定性的测量。

Thermostabilisation技术用于GPCRs结构研究
目前,thermostabilisation技术已经成功地应用于3种人类GPCPs。它们是β1AR ,A2AR以及神经降压素受体。通过thermostabilisation技术不仅能够反推蛋白质的氨基酸序列,还可以增加蛋白质的热稳定性。目前,β1AR 和A2AR的热稳定性已经可以分别提高8℃和14℃。这极大地增加了β1AR 和A2AR的稳定性,为研究和确定其序列和结构提供了基础。
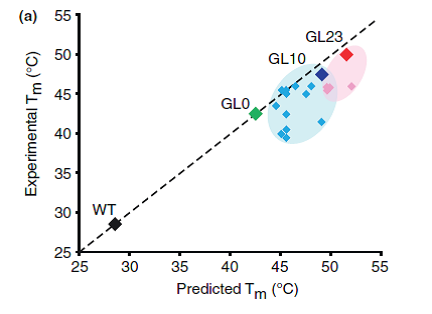
Thermostabilisation技术还可以将GPCPs的热稳定性较高的突变体结合和串联起来,从而生成热稳定性更高的GPCPs。如下图所示,A2AR有三种热稳定性较高的突变体:GL0、GL10以及GL23。通过thermostabilisation技术将其串联起来,生成了热稳定性很高的新突变体:A2AR-GL26。其热稳定性远远高于野生型A2AR(WT)。
Thermostabilisation技术用于药物研发
任何改变GPCPs热稳定性的技术都将改变其药理学性质,thermostabilisation技术也不例外。在热稳定性增加之后,GPCPs与配体的结合力将会发生改变。例如,A2AR的热稳定性增加了之后,其与ZM241385、CGS15943、SCH58621的结合力显著性增加。如下图所示,A2AR-GL26的结合力远远大于A2AR-GL23;而A2AR-GL23又远远大于A2AR-GL0。
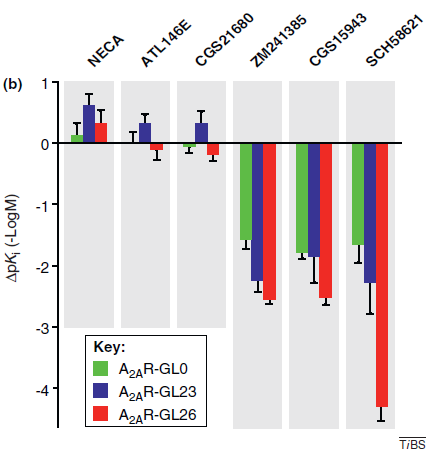
因此,可以通过改变GPCPs的热稳定性,调节其与配体的结合能力。在需要增加结合能力的时候,有意识地增加其热稳定性;而在需要减弱其结合能力的时候,有意识地降低其热稳定性,从而达到改变其药理学性质的目的。
G-蛋白偶联受体(G-protein-coupled receptors,GPCRs)是生物学和医学上非常重要的膜蛋白,但是,由于其结构的不稳定性,造成了研究的困难。热稳定技术(thermostabilisation)一方面通过测定GPCRs的热稳定性来反推其结构和序列,另一方面,可以直接改变GPCRs的热稳定性来改变其药理学性质。热稳定技术(thermostabilisation)在药物开发、基础研究以及临床治疗方面正在得到越来越广泛的应用。
参考文献
A crystal clear solution fordetermining G-protein-coupled receptor structures
来源:解螺旋
2016-06-13