相信如何提高目的重组蛋白的诱导表达量是很多同学在研究中都会遇到的问题。记得小编在读书的时候就经常在研究这个问题,泡了无数论坛,看了无数帖子,尝试过IPTG的诱导浓度、培养基成分、诱导温度、诱导时间,甚至让别的公司帮忙做密码子优化(将目的片段通过全基因合成的方式合成出来)。总的来说,提高IPTG浓度是可以提高目的蛋白的诱导表达量的,但一般也就用到1mM的浓度,再高对细胞有毒性; 培养基营养越丰富,表达量越高,所以如果追求表达量的话,就不要用LB培养基了,用自动诱导培养基吧; 诱导温度,温度越低表达量越低,但是可溶的比例一般来说会越高,所以如果追求表达量可以尝试37℃或者42℃(没试过42℃);诱导时间,这个跟培养基成分及供氧情况很有关系,如果供氧不足/营养不够,提高时间会起到反效果。
综合而言,我一般用的重组蛋白诱导表达条件是固定的,有时候要追求可溶表达,顶多就调整下诱导温度(25℃)。条件就是:自动诱导培养基(不用额外的IPTG),37℃,20h。一般来说大分部蛋白的表达量都还可以。
但有些蛋白的表达量不行,或者某些蛋白需要长期大量使用,因此提高这些重组蛋白的诱导表达量就十分有必要了,如果进一步提高呢?
我们都知道,蛋白质的表达量和蛋白质的翻译效率有关,翻译效率又跟mRNA的二级结构又有关系,如果mRNA形成了复杂的二级结构,会导致核糖体无法顺畅的将整个mRNA读通,甚至会提前从mRNA上掉下来。一般公司号称的密码子优化,也就是通过替换掉一些稀有密码子,显然如果不从二级结构上考虑的话,是没法提高蛋白质的表达量的,而事实也确实如此。在公司做研发的几年中,做过多个蛋白的密码子优化(通过全基因合成的方式),结果差强人意。
笔者今天介绍的方法,不是从二级结构上来预测的(据我所知,目前没有比较准确的方法来预测mRNA的二姐结构),而是一种简单、高效的方法:通过优化目的基因的5'部分DNA序列,而且不需要通过软件预测,完全随机,包含所有可能(理论上),且不改变氨基酸序列。
原理:蛋白质的翻译效率很大程度上跟翻译起始效率有关,因此mRNA的5'端必须得很好翻译,最好不要有复杂的二级结构;通过PCR的方法在基因的5‘端引入简并序列,构建克隆,挑选多个克隆
,诱导表达之,SDS-PAGE电泳检测表达量的高低,挑选高表达克隆进行测序。可参考这篇文章来设计简并序列。
实验步骤:
1.设计目的重组蛋白质的N端10-15个氨基酸的简并序列。
2.引物合成上述简并序列,同时设计合成目的基因反向引物。
3.PCR扩展目的基因,这样在目的基因的5‘端就引入了兼并序列,同时不改变氨基酸序列。
4.双酶切,插入到目标载体。
5.转化。
6.挑选多个克隆(比如100-200个)到1.5ml EP管,直接诱导表达(记得带上为改造克隆菌株的对照)。
7.SDS-PAGE检测。
8.挑选高表达的多个克隆,测序。
怎么样?是不是很简单,不需要做太多的摸索,标准化的操作。
下面就给大家一个案例(我手头上有很多这样的案例,但涉及到商业秘密,不宜展示太多)
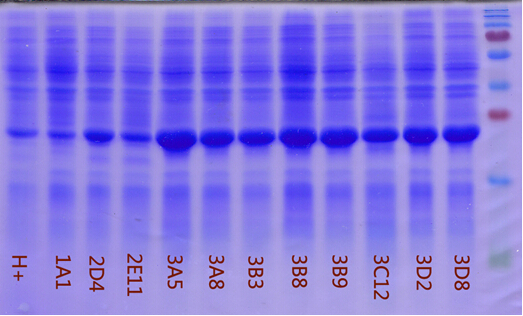
H+: 原始的菌株,表达量比较低。
1A1,2D4...3D2,3D8:通过SDS-PAGE鉴定的几个高表达菌株,表达量明显提高。后面的测序结果表明,3D2和3D8的序列一模一样。
下图展示的就是H+和3D8的5'端DNA序列的比对:

红框标记的是两条序列不一样的地方,怎么样?就变了几个碱基的序列,表达量就千差万别。这样的例子太多,值得一试!
原文链接: http:/www.novoprolabs.com/support/articles/201409271105.html
(by admin)
2014-09-27
